Введение. Фитиновая кислота, или мио-инозитгексафосфорная кислота представляет собой сложный эфир циклического шестиатомного полиспирта мио-инозитола (или мио-инозита) и шести остатков ортофосфорной кислоты. В настоящее время в зарубежной литературе широко обсуждаются антиоксидантные эффекты фитиновой кислоты [1-10], лежащие в основе механизмов её действия, в том числе в составе противоопухолевой терапии [2, 4, 8, 9]. Фитиновая кислота предотвращает образование активного ОН• радикала, что связано с её сильной хелатирующей способностью. Таким образом, она полностью предотвращает железо-катализируемое образование радикалов, что отличает её от других химических соединений, проявляющих антиоксидантную активность [1, 2]. Изучена и доказана эффективность фитиновой кислоты в снижении активности липопероксидации в клетках печени, в частности, при моделировании алкоголь-индуцированного стресса [3]. Однако интерес составляет и изучение дозозависимых эффектов фитиновой кислоты в отношении биологических объектов, поэтому целью настоящей работы стало исследование антиоксидантной активности различных концентраций фитиновой кислоты.
Материал и методы исследования. Изучен характер реакции цельной консервированной крови на воздействие растворов фитиновой кислоты 5, 10, 30 и 100 mМ. Для эксперимента использовали кровь, полученную от 10 доноров (по 25 мл). Объём разделяли на 5 порций (интактную, на которую не оказывали воздействий, и 4 опытных). В каждую из опытных порций крови добавляли по 0,5 мл водного раствора фитиновой кислоты в концентрациях 5, 10, 30 и 100 mМ соответственно. Экспозиция после воздействия составляла 5 минут.
После воздействия в плазме крови и эритроцитах каждой порции определяли интенсивность хемилюминесценции, максимальную фотовспышку и общую антиоксидантную активность методом Fe-индуцированной биохемилюминесценции на аппарате БХЛ-06. Активность супероксиддисмутазы (СОД) оценивали по Т.В. Сироте (1999) [11]. Уровень малонового диальдегида (МДА) в плазме определяли с помощью тест-набора (ЗАО «АГАТ»).
Результаты обрабатывали с использованием программы Statistica 6.0.
Результаты и обсуждение. Анализ интенсивности липопероксидации в плазме крови позволил установить, что введение фитиновой кислоты обуславливает дозозависимое нарастание данного параметра (рис. 1).
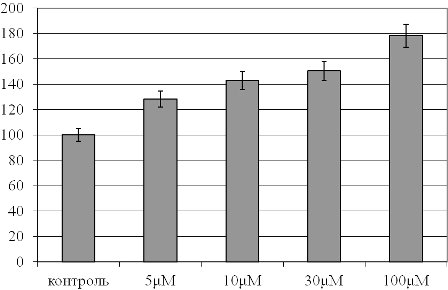
Рис. 1. Интенсивность перекисного окисления липидов в плазме крови при действии растворов с различными концентрациями фитиновой кислоты (в % относительно контрольного образца, принятого за 100%).
В частности, при воздействии минимальной (5mM) и максимальной (100mM) из использованных концентраций вещества прирост значения параметра составил 28% и 79% по отношению к контрольному образцу соответственно (р<0,05).
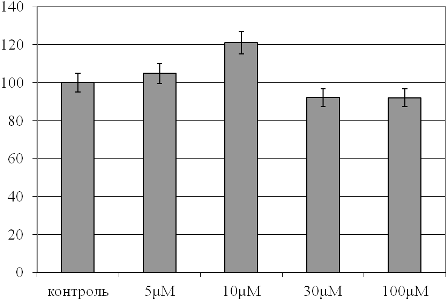
Рис. 2. Общая антиоксидантная активность плазмы крови при действии растворов с различными концентрациями фитиновой кислоты (в % относительно контрольного образца, принятого за 100%).
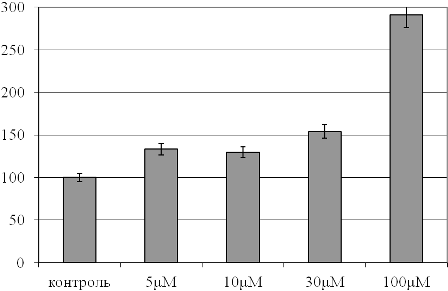
Рис. 3. Концентрация малонового диальдегида в плазме крови при действии растворов с различными концентрациями фитиновой кислоты (в % относительно контрольного образца, принятого за 100%).
Таким образом, наблюдается прямая линейная зависимость увеличения перекисного окисления липидов при увеличении дозы препарата.
Представляет интерес сопоставление этих данных с динамикой общей антиоксидантной активности плазмы крови рассматриваемых образцов (рис. 2). Установлено, что антиоксидантная активность плазмы максимальна при введении в образцы крови водных растворов фитиновой кислоты в концентрации 10 mM, возрастая в этом случае на 21% по сравнению с контролем (р<0,05). Более низкие или высокие концентрации соединения демонстрируют меньший уровень антиоксидантного потенциала, а применение 30 или 100 mM фитиновой кислоты вызывает даже заметное истощение антиоксидантных резервов относительно контрольного образца (р<0,05).
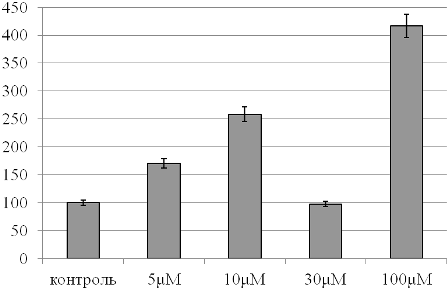
Рис. 4. Активность супероксиддисмутазы крови при действии растворов с различными концентрациями фитиновой кислоты (в % относительно контрольного образца, принятого за 100%).
Известно, что дополнительным параметром, характеризующим процессы липопероксидации и, следовательно, несущим косвенную информацию о балансе в системе «про- / антиоксиданты», является определение концентрации малонового диальдегида. В связи с этим нами проведена оценка уровня данного метаболита в плазме крови всех образцов (рис. 3). Выявлено, что введение низких концентраций фитиновой кислоты приводило к умеренному нарастанию данного показателя (на 33, 29 и 50% для 5, 10 и 30mM соединения соответственно; р<0,05), что свидетельствует о минимальной активации процессов перекисного окисления данными дозами агента и подтверждает результаты биохемилюминесцентного анализа. Дальнейшее увеличение дозы фитиновой кислоты вызывало существенно более выраженное повышение концентрации малонового диальдегида в плазме крови (в 2,9 раза; р<0,05). Таким образом, учитывая результаты оценки антиоксидантного потенциала плазмы, эффекты 5 и 10 mM растворов фитиновой кислоты в отношении перекисного окисления липидов при введении её в образцы крови носят адаптивный характер, оптимизируя функционирование системы «про- / антиоксиданты». Данное заключение можно сделать на основании пропорционального увеличения интенсивности липопероксидации и антиоксидантной активности плазмы крови при использовании этих концентраций соединения [12-14]. В то же время 100 mM раствор фитиновой кислоты проявляет выраженные прооксидантные свойства, многократно стимулируя процессы перекисного окисления липидов в плазме и расходуя ее антиоксидантный потенциал.
Одной из составляющих антиоксидантной системы крови является супероксиддисмутаза, утилизирующая супероксид-анион радикал. В целях уточнения механизма антиоксидантного действия фитиновой кислоты нами проведена оценка ее активности в контрольном и опытных образцах (рис. 4). Обнаружено, что при добавлении 5 и 10 mM растворов фитиновой кислоты активность супероксиддисмутазы в 1,7 и 2,5 раза выше, чем в контрольном образце (р<0,05). Дальнейшее нарастание концентрации изучаемого химического соединения (до 30 mM) не вызывает индукции каталитических свойств фермента, что может быть обусловлено комбинацией двух факторов: компенсаторной стимуляции активности энзима вследствие интенсификации липопероксидации и вовлечением практически всего пула фермента в утилизацию образующихся активных форм кислорода. Это косвенно указывает, что данная концентрация вещества является предельной для тестируемых образцов крови. Использование максимальной из выбранных концентраций фитиновой кислоты (100 mM), как показано выше по уровню малонового диальдегида и результатам оценки биохемилюминесценции, приводит к выраженной стимуляции процессов перекисного окисления липидов как в плазме крови, так и в эритроцитарных мембранах. Как следствие, это вызывает компенсаторную гиперактивацию супероксиддисмутазы («феномен метаболической дизадаптации»).
Заключение. На основании полученных результатов можно заключить, что в условиях in vitro фитиновая кислота оказывает доззависимое действие на про- и антиоксидантные системы крови, причем низкие концентрации соединения (5-10 mM) проявляют антиоксидантные свойства, а высокие (в особенности, 100 mM) – выраженные прооксидантные. Установлено, что наиболее оптимальное действие характерно для 10 mM раствора фитиновой кислоты, умеренно активирующего процессы липопероксидации в сочетании с значимым пополнением антиоксидантных резервов крови.
