Введение. По использованию жесткого эндоскопа при клипировании аневризм передних отделов виллизиева был представлен большой материал итальянскими учеными Profeta G. с соавт. в 2004 г. [22] Также в последние годы представлена серия работ НИИ им. Н.В. Склифосовского по вариантам применения ассистирующей эндоскопии при клипировании артериальных аневризм [3]. Особенности хирургической анатомии при клипировании аневризм головного мозга в процессе птерионального и субтемпорального доступов выделили американские ученые Peris-Celda M., Rhoton AL Jr. с соавт. 2013 г. [21] Эндоскопическая ассистенция позволила авторам получить полноценные данные микрохирургической анатомии при всех типах аневризм переднего отдела виллизиева круга, за исключением аневризм СМА. В 2013 г. Schroeder H.W. выделил основные принципы техники эндоскопической ассистенции в хирургии опухолей желудочковой системы [23]. Роль эндоскопической ассистенции при микроваскулярной декомпрессии тройничного нерва отражена в работах Broggi M. с соавт. Италия, Setty P. с соавт. США 2013 г. [12] Данные эндоскопической ассистенции при различной патологии ММУ представлены НИИ нейрохирургии им. Н.Н. Бурденко 2012 г. под руководством проф. Шиманского В.Н. с соавт. [8].
Существенный вклад в развитие эндоскопии внесли отечественные ученые А.Н. Коновалов, В.В. Крылов, Ю.А. Щербук, А.Г. Меликян, Д.Н. Капитанов, А.Н. Шкарубо. Ими опубликованы работы по оперативной эндоскопии при гидроцефалии, воспалительных и опухолевых процессах, травматических интракраниальных кровоизлияниях, сосудистой нейрохирургии, при лечении грыж межпозвонковых дисков и назальной ликвореи [1-4, 7-9, 11].
Целью исследования является анализ собственного опыта применения эндоскопической ассистенции в хирургии аневризм головного мозга, опухолей основания черепа и желудочковой системы.
Материалы и методы. Представлен проспективный анализ 128 пациентов с онкологической и сосудистой патологией, которые проходили лечение в ГКБ им. С.П. Боткина с 2007-2013 г. Состояние пациентов при сосудистой патологии головного мозга оценивалась по шкале Hunt-Hess (HH), пациенты с опухолевой патологией оценивались по шкале Карновского.
В I группу вошли 64 пациента оперированные с эндоскопической ассистенцией. Пациенты c артериальными аневризмами (АА) головного мозга – 25 (39%), с опухолями – 39 (61%), из них передней черепной ямки (ПЧЯ) – 5 (12,8%); средней черепной ямки (СЧЯ) – 17 (43,5%), задней черепной ямки (ЗЧЯ) – 14 (35,9%) пациентов; опухоли III желудочка 3(7,8%). Средний возраст в I группе составил – 49,5 лет, минимальный возраст – 25 лет, максимальный – 72 года. Во II группу вошли 64 пациента оперированные только c операционным микроскопом. Из них пациентов оперированных по поводу АА головного мозга – 25 (39%), с опухолями - 39 (61%): передней черепной ямки – 4 (10,3%); средней черепной ямки – 12 (30,8%), задней черепной ямки – 15 (38,5%) пациентов; опухоли III желудочка 6 (15,4%); желудочкового треугольника 1(2,5%); пинеальной области 1(2,5%). Средний возраст в основной группе составил – 49,7 лет, минимальный возраст – 21 год, максимальный 71 год.
В I группе, с АА сосудов головного мозга, из 25 пациентов с тяжестью состояния по шкале Hunt-Hess (HH) I составило 12 (48%) пациентов, с HH II – 7 (28%), с HH III – 4 (16%) и с HH IV – 2 (8%) пациента. Во II группе из 25-ти пациентов с HH I составило 14 (56%), с HH II – 6 (24%), с HH III – 5 (20%) пациентов.
Все пациенты с АА I и II группы перенесли субарахноидальное кровоизлияние (САК) и оперированы в острый период (до 3-х суток).
В I группе с опухолями головного мозга из 39 пациентов тяжесть состояния по шкале Карновского 100-90% составило у 31 больного (79,5%), 80% – 7 (17,9%), 70-60% баллов – 1 (2,6%). Во II группе из 39 пациентов с общим состоянием по шкале Карновского 100-90% составило 34 (87,2%), 80% – 2 (5,1%), с 50% – 1 (2,6%), с 40-30% – 2 (5,1%) пациента.
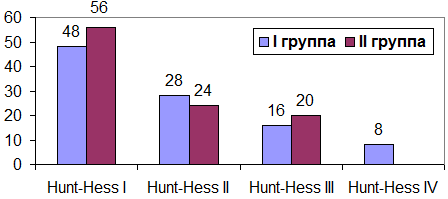
Рис. 1. Соотношение тяжести состояния в I и II группе по шкале Hunt-Hess (%).
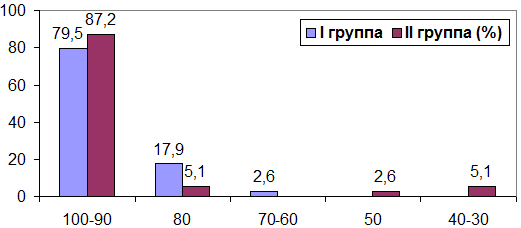
Рис. 2. Соотношение пациентов в I и II группе по шкале Карновского при опухолях головного мозга (%).
Таблица 1. Локализация АА в I и II группе
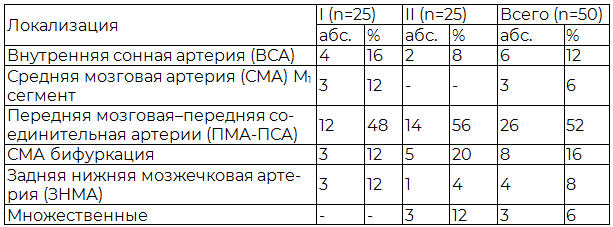
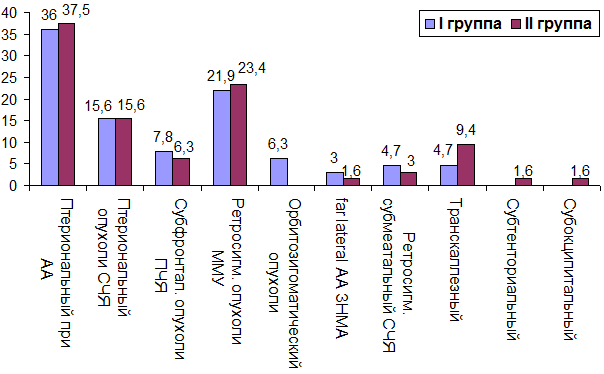
Рис. 3. Соотношение оперативных доступов при различной патологии головного мозга в I и II группе (%).
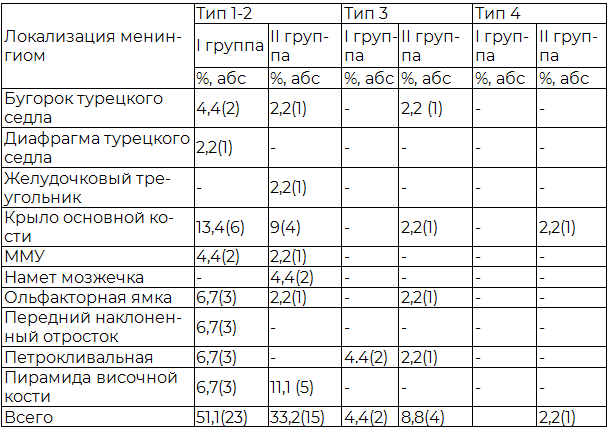
Таблица 2. Локализация и морфология опухолей I и II группы
Результаты и обсуждение. Общий клинические исход, а также исходы при АА оценивались по Шкале исходов Глазго (ШИГ). В I группе у пациентов с АА: хорошие результаты по ШИГ → 19(76%); умеренная инвалидизация → 3 (12%); грубая инвалидизация → 2 (8%); летальный исход 1 (4%). Во II группе: хорошие результаты по ШИГ → 16(64%); умеренная инвалидизация у → 4(16%); грубая инвалидизация у → 3 (12%); летальный исход в → 2 (8%) случаях. В нашей серии наблюдений наиболее эффективное применение эндоскопической ассистенции отмечено при АА ВСА (области устья задней соединительной артерии (ЗСА) и передневорсинчатой артерии (ПВА)) заднего расположения, а также при АА устья ЗНМА. Эндоскопическая ассистенция позволила оценить топографо-анатомические отношения шейки АА, перфорантных артерий, положение браншей после клипирования. Наименьший эффект применения эндоскопической ассистенции отмечен при клипировании АА ПМА-ПСА. Это связанно с узостью расстояния между ветвями ПМА. Наибольшую информативность эндоскопии получили из оптикокаротидного треугольника и ретрокаротидного пространства, в 3-х случаях удалось отметить неполное клипирование АА и провести коррекцию положения клипсы (рис. 4-6).
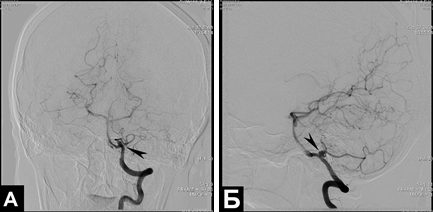
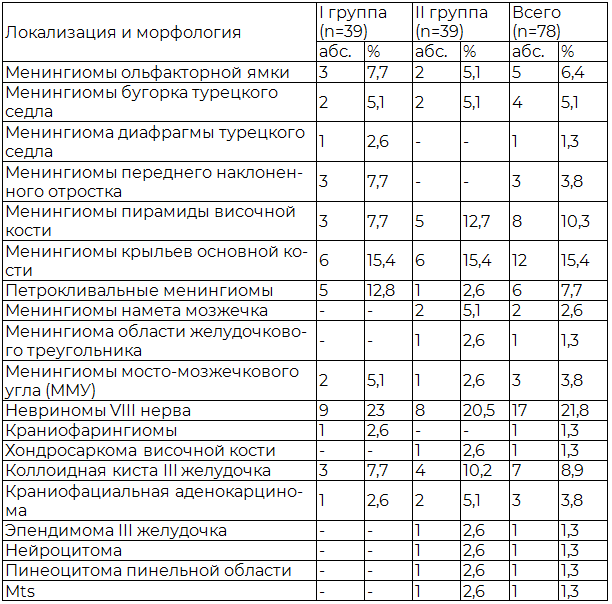
Рис. 4. Церебральная ангиография. На серии ангиограмм верифицируется мешотчатая артериальная аневризма области устья левой задней нижней мозжечковой артерии.
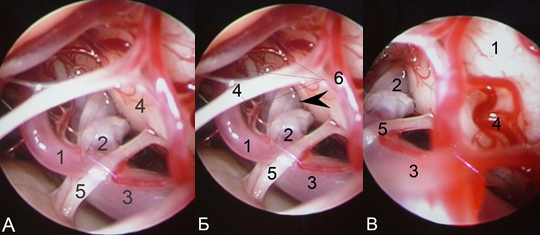
Рис 5. А) Эндоскопическая ассистенция 0º, 30° при выделении АА устья ЗНМА 1. – левая ЗНМА; 2. – шейка АА ЗНМА; 3. – позвоночная артерия (ПА); 4. – ствол мозга; 5. – IX, X, XI - каудальная группа нерва; Б) 1. – левая ЗНМА; 2. – шейка АА ЗНМА; 3. – позвоночная артерия; 4. – корковая артерия; 5. – IX, X, XI - каудальная группа нерва; 6. – перфорирующие артерии; В) 1. – ствол мозга; 2. – АА; 3. – позвоночная артерия (ПА); 4. – корковые артерии; 5. – IX, X, XI - каудальная группа нерва.
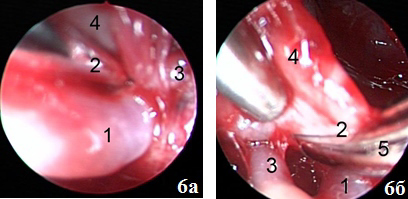
Рис 6. А) (эндоскопическая ассистенция 30° медиальная сторона) контроль клипирования аневризмы: 1. – позвоночная артерия; 2. – бранш клипсы; 3. – левая ЗНМА; 4. – тело аневризмы; Б) (латеральная сторона) – 1. – ПА, 2. – шейка АА; 3. – ЗНМА; 4. – АА; 5. – клипса.
Y. Takaishi и соавт. (2002) с помощью эндоскопа на анатомическом материале подчеркнули возможность осмотра ЗСА, ПВА без тракции, смещении ВСА и окружающих анатомических структур. Они также исследовали анатомические взаимоотношения ЧМН, БА и ее ветвей при доступах к ЗЧЯ [24]. По данным Y. Kato с соавт. [17] идеальным вариантом для использования эндоскопической ассистенции при АА являются неразорвавшиеся АА, или АА после САК благополучно прошедшие острый период кровоизлияния. Эффективность применения эндоскопической ассистенции показана M. Taniguichi: и соавт. (1999) уточнялись интраоперационные топографо-анатомические взаимоотношения в 81,5% случаев; в 16% получена информация об АА и перфорантных артериях [25]. В серии исследований C. Kalavakonda с соавт. (2002) [15] исследованию подверглись 79 пациентов, проходившие лечение в период с июля 1998 по июнь 2001 г. Эндоскопическая ассистенция эффективна у 63% при визуализации несущей артерии АА, перфорирующих артерий; недоступных осмотру при микроскопии в 45% случаев. По данным НИИ скорой помощи им. Н.В. Склифосовского [3] с использованием видеоэндоскопической асситенции оперировано 33 пациента. Эффективность эндоскопии выявлена в 79% случаев, неэффективна в 21%. При этом видеоэндоскопическая ассистенция в 33% позволила верифицировать АА, в 15% перфорирующие артерии, в 30% АА и перфоранты.
Таблица 3. Эффективность визуализации аневризмы и перфорантных артерий при помощи эндоскопической ассистенции
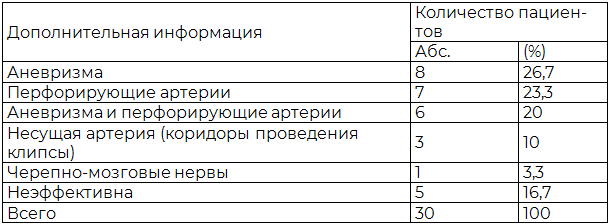
Рис. 7. Соотношение результатов лечения в I и II группах у пациентов с АА головного мозга по ШИГ (n=42, p=0,55).
При оценке клинического исхода при опухолях головного мозга использовалось шкала Eastern Cooperative Oncology Group (ECOG-ВОЗ).
Результаты применения эндоскопической ассистенции у пациентов с опухолями в I группе: выписано 36(92,3%), летальность в послеоперационном периоде составила 3(7,7%). Исход после оперативного вмешательства по шкале ECOG 0 → 16 (41%); ECOG 1 → 15(38,4%), ECOG 2 → 4 (10,3%); ECOG 3 → 1(2,6%); ECOG 4 нет; ECOG 5 → 3(7,7%). Во II группе с опухолями головного мозга из 39-ти пациентов с общим состоянием по шкале Карновского 100-90% составило 31 (79,5%), 80% → 7 (17,9%), 70-60% → 1 (2,6%). ECOG 0 после оперативного вмешательства при 100-90% в 13 (33,3%), ECOG 1 → 11 (28,2%), ECOG 3 → 4 (10,3%) пациентов; ECOG 5 → 3(7,7%). При 80% ECOG 1 → 3 (7,7%), ECOG 2 → 4(10,3%). При 70-60% ECOG 3 → 1(2,6%) (рис. 8-11).
Рис. 8. Менингиома ЗЧЯ с преимущественным ростом из пирамиды височной кости.
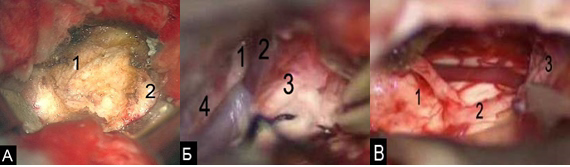
Рис. 9. А) (микроскопия) менингиома мосто-мозжечкового угла – 1, ткань мозжечка – 2; Б). диссекция ЧМН и сосудов на этапе удаления: тройничный нерв (n. trigeminus) – 1; вена Денди (v. flocularis) – 2; лицевой нерв (n. facialis) – 3; ствол мозга – 4; В). Стволовые структуры – 1; лицевой нерв (n. facialis) – 2; полушарие мозжечка – 3.
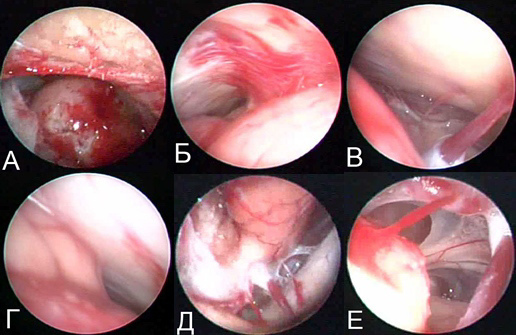
Рис. 10. А) Микроскопия; Б) Эндоскопическая ассистенция 70о – верхний полюс опухоли с матриксом на пирамиде височной кости; В) – латеральные отделы нижнего полюса опухолевого узла; Г) – n. facialis; Д) – вена Денди медиально, корковые сосуды, n. facialis; Е) – n. trigeminus.
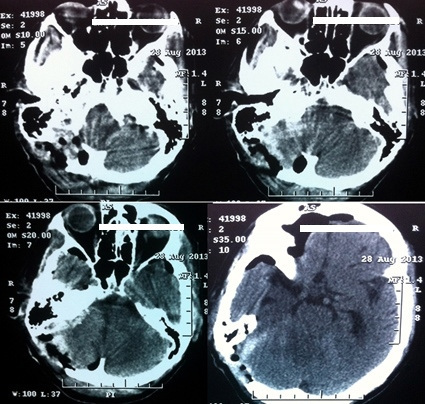
Рис. 11. Послеоперационный контроль удаления менингиомы ЗЧЯ с преимущественным ростом из пирамиды височной кости.
Анализ случаев применения эндоскопической ассистенции при удалении опухолей субфронтальным доступом определил, что наиболее существенные преимущества эндоскопии, при этом виде операций заключаются в возможности полноценной визуализации полости турецкого седла и участков параселлярной зоны, недоступных прямому обзору при использовании микроскопа. При помощи такой техники можно оценить целостность мелких ветвей, отходящих от супраклиноидного отдела ВСА, ПМА- ПСА и участвующих в кровоснабжении хиазмы и зрительных нервов. Это позволяет выполнять супраорбитальный доступ, избегая двусторонней субфронтальной краниотомии.
Особые трудности хирургического лечения представляют менингиомы непосредственно прилегающие к турецкому седлу, кавернозному синусу и клиновидным отросткам. Опухоль обрастает супраклиноидный отдел ВСА, часто вплоть до ее развилки, нередко циркулярно окружает СМА и инфильтрирует стенку кавернозного синуса. Радикальное удаление опухолей в таких случаях неоправданно, если нельзя сохранить ВСА и ее магистральные ветви. При опухолях мягкой консистенции, сосуды удается сравнительно легко выделить при использовании эндоскопической ассистенции. Необходимо также учитывать особенности инфильтративного роста некоторых опухолей СЧЯ, при которых оптимальным является орбитозигоматический доступ, позволяющий снизить тракцию лобной и височной долей, а также расширяет хирургические коридоры для эндоскопической ассистенции.
Внедрение эндоскопической ассистенции значительно повысило возможность радикального удаления неврином слухового нерва, менингиом ММУ. Большое значение в решении вопроса о целесообразности расширения объема оперативного вмешательства в каждом конкретном случае возможно при использовании ассистирующая эндоскопия. В некоторых случаях применение расширенного латерального доступа (far lateral) позволяло увеличить информативность эндоскопии, для оценки расположения передней мозжечковой артерии (ПМА), ЗНМА, передней нижней мозжечковая артерии (ПНМА), стволовых вен, каудальной группы нервов.
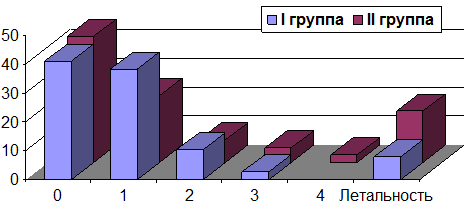
Рис. 12. Соотношение результатов лечения (по исходам) в I и II группе при опухолях головного мозга по шкале ECOG-ВОЗ (n=78, p=0,18).
Один из основных показателей эффективности применения эндоскопической ассистенции в нейрохирургии является радикальность удаления опухолей. Радикальность удаления опухолей в I и II группе оценивалась по шкале A.K. Grekow. А также радикальность удаления менингиом по шкале P.Simpson.
Таблица 4. Радикальность удаления опухолей в I и II группе по A.K. Grekow (p=0,49)
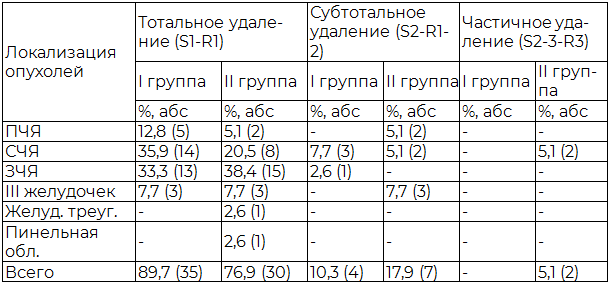
Таблица 5. Радикальность удаления менингиом по шкале P.Simpson
Достоверность различий проводилась с помощью непараметрического критерия Манна – Уитни и использованием t-теста. Достоверных различий результатов лечения при АА головного мозга по клиническим исходам между I и II группами при p=0,51 не выявлено, а также при оценке летальности АА в I и II группах p=0,55, при летальности в I группе 4%, во II группе 8%. Достоверность различий в уровнях летальности при р=0,18 у пациентов I и II группы с опухолями головного мозга. Летальность в I группе 7,7%, во II группе 17,9%. Показатели инвалидизации и качества жизни после оперативного лечения при р=0,49 в I и II группах не убедительны. Однако, при рассмотрении процентных соотношений по клиническим исходам в I группе больных, показатели качества жизни выше.
В нашей работе детально проведен анализ летальности пациентов. Определены факторы влияющие на результаты оперативного лечения при патологии глубинной локализации головного мозга.
Выводы
1. Эндоскопический видеомониторинг позволяет дополнительно осуществлять высокоэффективный визуальный контроль на наиболее ответственных этапах операции в «слепых» зонах, недоступных прямому обзору операционного микроскопа, снижает риск травматизации важных анатомических структур, улучшает показатели клинических исходов в послеоперационном периоде. Не мешает основным микрохирургическим манипуляциям.
2. Для проведения эндоскопической ассистенции при нейрохирургических операциях на мозге достаточно стандартной эндоскопической стойки и набора эндоскопов с углами зрения 0°, 30° и 70°, а также подготовленных специалистов владеющих этим методом.
3. Показанием к применению эндоскопической ассистенции являются нейрохирургические вмешательства при удалении базальных опухолей ПЧЯ и СЧЯ, что позволяет снизить объем краниотомии, лучше идентифицировать глубинный край опухолей, непосредственно примыкающий к задним поверхностям сосудов виллизиева круга. Противопоказанием может быть выраженный отёк мозга и узкие хирургические пространства, активное артериальное кровотечение.
4. При клипировании артериальных аневризм эндоскопическая ассистенция дополнительно улучшает осмотр области аневризмы, особенно АА ВСА области ЗСА и ПВА заднего расположения, где прямая может быть затруднительна, что важно для сохранения перфорантных артерий.
5. Эндоскопическая ассистенция при удалении опухолей ММУ обеспечивает более щадящий подход к основанию черепа, сосудистым и нервным образованиям этой зоны, повышает радикальность вмешательства, снижает травматизацию функционально значимых структур головного мозга.
