Заболеваемость мочекаменной болезнью (МКБ) в мире составляет не менее 3% и продолжает прогрессивно возрастать [1]. Подходы к диагностике и лечению больных МКБ в значительной степени пересмотрены в пользу высокотехнологичных методик. Метод дистанционно ударно-волновой литотрипсии (ДУВЛТ) изменил тактику ведения и лечения пациентов с МКБ. ДУВЛТ зарекомендовала себя, как малотравматичный и экономически выгодный способ лечения МКБ и является методом выбора по сравнению с эндоскопическими и открытыми оперативными вмешательствами [2, 3]. ДУВЛТ проводят на литотриптерах с различной генерацией ударных волн. Вне организма создаются короткие импульсы энергии в виде ударных волн, которые в зоне фокуса оказывают давление до 160 кПа, что и приводит к разрушению конкремента.
В исследованиях доказано, что кроме терапевтического, ударная волна оказывает повреждающее действие. Дезинтеграция конкремента не должна быть основной целью при ДУВЛТ, так как вероятность рецидива достаточно велика.
В исследованиях Н.А. Лопаткина с соавт. [4], проведенных в эксперименте, было выявлено, что на 2—11-й день после ДУВЛТ происходило нарастание признаков полнокровия сосудов микроциркуляторного русла, набухание базальных мембран, расширение мезангиального пространства. В клетках эпителия выявлялись признаки зернистой дистрофии. Постепенно реакция сосудистой системы уменьшалась и обычно исчезала к 20-му дню. В тканях морфологические изменения проходили примерно к 35-му дню после ДУВЛТ. Результатом этого воздействия является склерозирование почечной паренхимы с последующим снижением функций. Вот почему динамическое наблюдение за функциональным состоянием почек должно осуществляться на этапах лечения [4, 5].
В настоящее время общепринятым в оценке скорости клубочковой фильтрации явлется определение креатинина сыворотки крови (сКр). Уровень сКр не является достаточно чувствительным показателем сниженной скорости клубочковой фильтрации (СКФ), так как только у 60% больных, имеющих значимое снижение СКФ, сКр сыворотки повышен [6].
У больных МКБ основным механизмом формирования нефрофиброза является повреждение тубулоинтерстициальной ткани [7, 8].
За последнее время предложен ряд биомаркеров, экскретирующихся с мочой и позволяющих дифференцировать острое и хроническое повреждение почек. Одним из таких маркеров является бета2-микроглобулин (бета2-МГ). Бета-МГ – низкомолекулярный белок (11800 Да), присутствующий на поверхности ядросодержащих клеток в качестве легкой цепи антигена главного комплекса гистосовместимости – HLA.
У взрослых людей скорость продукции этого белка относительно постоянна. Элиминация бета2-МГ происходит в почках, где он подвергается фильтрации и затем практически полной реабсорбции в проксимальных канальцах. В норме в моче определяются лишь следовые количества бета2-МГ. Уровень биомаркера возрастает при снижении почечного клиренса, при повреждении клеток проксимальных канальцев.
Цель исследования – оценить степень повреждения тубулоинтерстициальной ткани после ДУВЛТ у больных с нефролитиазом с помощью иммуноферментного метода определения уровня бета2-МГ в моче.
Бета2-МГ является стандартным индикатором низкомолекулярной тубулярной протеинурии, характерной для всех состояний, сопровождающихся поражением интерстициальной ткани почек.
Материалы и методы исследования. Обследовано 48 пациентов с нефролитиазом, оперированных в урологическом отделении ГБУЗ «Тамбовская областная клиническая больница». Группу контроля составили 20 практически здоровых добровольцев. Все пациенты были разделены на 2 группы. Первую группу составили 23 больных, которым потребовался 1 сеанс ДУВЛТ для достижения эффективной фрагментации. Плотность камней по данным компьютерной томографии у пациентов данной группы в среднем составила 800-1100 НU, количество импульсов за сеанс 2000-3000, мощность генератора 12-15,5 кВ. Размеры конкремента не превышали 1 см. Вторая группа включала 25 больных с камнями средней и высокой плотности (800-1300 НU и более), которым выполнено 2-4 сеанса ДУВЛТ за период лечения 1-3 мес., а количество импульсов составляло 2500-4000 за один сеанс, мощность генератора 14-18 кВ. Размеры конкремента не превышали 1,5 см.
Критериями исключения из исследования являлись: острый пиелонефрит, возраст старше 60 лет, обструкция мочевыводящих путей, почечная недостаточность в острой и терминальной стадиях, а также тяжелая сопутствующая патология.
Таблица 1. Клинико-лабораторная характеристика пациентов с нефролитиазом

Для определения уровня бета2-МГ брали утреннюю порцию мочи, собранную до проведения ДУВЛТ и на 1, 3, 5, 7, 14 сутки, 1 месяц, 3 месяца. Бета2-МГ в моче определяли иммуноферментным методом с использованием коммерческого набора ORGENTEC DiagnostikaGmbH, Германия. Анализ проводили в соответствие с инструкцией к набору реагентов, учет результатов реакции проводили на микропланшетном фотометре Multiscan Ascent производства Thermo Electron Corporation, Финляндия. Обработку данных и вычисление концентрации бета2-МГ проводили с использованием программы «Ascent Software™ ver.2.6» производства Thermo Labsystems, Финляндия. Результаты выражали в мкг/мл мочи.
Всем пациентам, кроме стандартных лабораторных и инструментальных показателей почечных функций (биохимические анализы крови и мочи, проба Реберга, Зимницкого, уровень мочевой кислоты и парат-гормона сыворотки крови, ультразвуковое сканирование почек, мультиспиральная компьютерная томография (МСКТ)), методом твердофазного ИФА определяли концентрацию бета2-МГ.
Результаты и их обсуждение. При оценке функционального состояния почек на дооперационном этапе с помощью бета2-МГ в моче выявлено повышение его концентрации у 90% обследованных (43 пациента).
У пациентов 1-й группы значительное повышение бета2-МГ было на 5-7-е сутки после процедуры ДУВЛТ. В то же время уже к 10-14-м суткам после лечения концентрация бета2-МГ снижалась до исходных значений, а в дальнейшем через 1-3 месяца отмечалось быстрое снижение концентрации биомаркера практически до контрольных значений (рис.1).
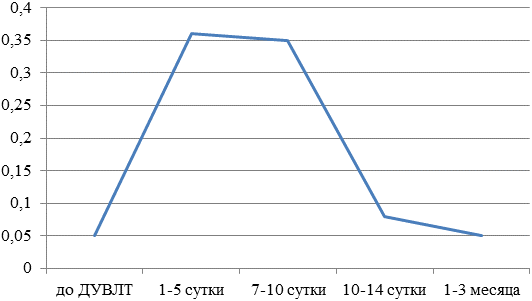
Рис.1. Концентрация бета2-МГ (мкг/мл) у пациентов 1 группы.
Во 2-й группе на 5-7-е сутки после операции аналогично происходит значительное повышение концентрации бета2-МГ, сохраняющееся практически неизмененным и на 10-14-е сутки после операции, что обусловлено дополнительным повреждением канальцев на фоне повторных оперативных вмешательств. Кроме того через 1-3 месяца после лечения у пациентов не происходит полной нормализации уровня бета2-МГ и составляет в среднем 0,2 мкг/мл (рис. 2).
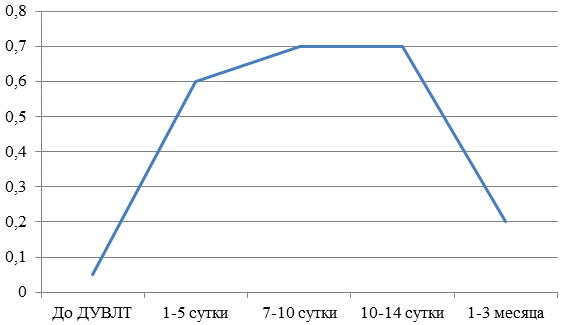
Рис. 2. Концентрация бета2-МГ (мкг/мл) у пациентов 2 группы.
Таким образом, сохраняющиеся высокие показатели уровня бета2-МГ через 1-3 месяца после операции указывают на канальцевое повреждение и на необходимость коррекции сроков повторных вмешательств. Максимальные уровни бета2-МГ определялись у пациентов 2 группы, что свидетельствует о выраженных тубулоинтерстициальных изменениях у этих больных.
Выводы
Использование бета2-МГ позволяет неинвазивным методом оценивать повреждение почечной ткани на этапах хирургического лечения и имеет практическое значение для определения тактики лечения больных и прогноза заболевания.
Выявление повышенных концентраций бета2-МГ в моче может являться скрининговым методом для оценки степени повреждения почечного тубулоинтерстиция.
Появление в клинической практике новых методов диагностики степени повреждения почечной паренхимы, позволило бы оптимизировать алгоритм дробления и скорректировать параметры волнового воздействия. В результате чего, способ позволяет уменьшить количество осложнений.
