Введение. В структуре злокачественных новообразований у взрослого населения России рак почки (РП) составляет около 3% всех опухолей. Средний возраст пациентов при выявлении заболевания в России около 60 лет. При этом мужчины болеют в 1,5 раза чаще, чем женщины [1]. По данным Аполихина О.И. и соавт. показано, что в 2010 году злокачественные новообразования почки составили 3,6% от всех злокачественных новообразований и занимают 10 ранговое место в структуре онкозаболеваемости среди обоих полов, а среди мужского населения они составили 4,3% всех злокачественных новообразований и занял 9 ранговое место в структуре онкозаболеваемости. Прирост заболеваемости за период 2005-2010 гг. составил +19,0% (+17,1% у мужчин и 21,3% - женщин) [2]. В США каждый год выявляется 30 000 новых случаев почечно-клеточного рака, в Европейском союзе - 20 000 и ежегодный темп прироста равен 2-3%. Мужчины в возрасте 50- 70 лет вдвое чаще, чем женщин имеют рак почки. Увеличение частоты почечно-клеточного рака за последнее десятилетие произошло как вследствие ухудшения экологических факторов, так и за счет развития диагностической техники и улучшения диагностики опухоли [3].
Золотым стандартом лечения РП является радикальное хирургическое лечение, однако в последние годы отмечается тенденция к расширению показаний к органосохраняющему лечения, что связано с увеличением частоты раннего выявления опухолей, когда размеры новообразования не превышают 3-5 см [4]. Ряд рандомизированных исследований последних лет показал, что резекция почки при РП имеет сопоставимые с нефрэктомией онкологические результаты, но при этом имеет лучшие функциональные последствия [5]. Основными критериями оценки эффективности органосохраняющего лечения является частота местных рецидивов и отдаленная онкоспецифическая выживаемость. Одними из основных причин локального рецидива, частота которого, по данным H. Schlichter et al, может достигать 17,2%, являются нерадикальность выполненной резекции почки и мультифокальный рост опухоли [6]. Экспресс-биопсия, выполненная в процессе органосохраняющего лечения РП, не может служить точным методом оценки хирургического края. Это связано с тем, что при ее выполнении отсутствует возможность четко визуализировать опухоль в крае резекции и местах, где производится биопсия, т.е. биопсия из различных участков области резекции берется случайным методом.
Следовательно, разработка методики, позволяющей лучше визуализировать подозрительные на опухоль участки с последующей биопсией из таких зон, является актуальной задачей на современном этапе. К таким методам может быть отнесена флуоресцентная диагностика, которая в настоящее время применяется при опухолях различной локализации. В урологии метод флуоресцентной диагностики широко используется для увеличения радикальности трансуретральной резекции мочевого пузыря при раке мочевого пузыря и контроля рецидивирования после проведенного лечения, позволяя осуществлять прицельную биопсию очагов с патологической флюоресценцией; чувствительность и специфичность диагностики нормальных и патологических тканей, по данным А. Sieron и соавт. - 96% и 65% [7]. Установлена высокая диагностическая ценность метода флуоресцентной диагностики в работе К.К. Каллаева для интраоперационного контроля радикальности открытых и лапароскопических оперативных вмешательствах при раке предстательной железы [8].
В мировой литературе представлены только единичные работы, в которых проводилось изучение возможностей флуоресцентной диагностики при РП. При этом исследования, как правило, носили пилотный характер и включали крайне ограниченные когорты пациентов. Кроме того, в них отсутствуют четкие рекомендации о применении метода. Hoda M.R., Popken G. проанализировали результаты применения фотосенсибилизатора 5-ALA для определения характера хирургического края при лапароскопической парциальной нефрэктомии. При этом чувствительность метода составила 95%, специфичность – 94% и точность диагностики равна 98%. Авторы пришли к выводу что, фотодинамическая диагностика является надежным инструментом для оценки типа опухоли и статусе хирургического края во время лапароскопической органосохраняющей хирургии [9]. В отечественной литературе имеются публикации в который описан опыт фотодинамической диагностики (ФД) рака почки на базе ФГБУ «НИИ урологии», г. Москва [10]. Таким образом, вышеуказанные обстоятельства обусловили актуальность настоящего исследования.
Материалы и методы. В исследование включены данные 70 больных с РП, которым были проведены сл. операции: 20 (29%) больным выполнена открытая резекция почки, 50 (71%) - лапароскопическая резекция почки. Средний возраст больных составил 28 – 74 (52,25) год. Все оперативные вмешательства выполнялись в условиях тепловой ишемии 10-30 (15,6) мин. В изучаемой группе пациентов было 42 мужчин (60%) и 28 женщины (40%). У 34 (49%) пациентов опухоль была локализована в левой почке, у 32 (46%) пациентов в правой почке, двухстороннее поражение - у 4 (5%) пациентов. Размер опухоли составлял 1,5-4,5(3,2) см. Больные в зависимости от стадии распределились следующим образом: рT1а – 66 (94%), pT1b – 2(3%), рТ2а – 2(3%) (табл. 1).
Таблица 1. Общая характеристика больных
В качестве фотосенсибилизатора был использован отечественный препарат «Аласенс» (5-аминолевулиновая кислота). 5-аминолевулиновая кислота является предшественником протопорфирина IX в организме человека. Механизм ее действия основан на способности опухолевых клеток к повышенному накоплению в присутствии экзогенной 5-аминолевулиновой кислоты фотоактивного протопорфирина IX, наличие которого можно определить по специфической флюоресценции, вызываемой специальными источниками излучения. Протопорфирин IX накапливается и сохраняется в значительном количестве в опухоли в течение нескольких часов, в то время как в нормальных клетках он быстро превращается в фотонеактивный гем под действием феррохелатазы. Результатом этого служит высокий флюоресцентный контраст опухоли относительно окружающей ткани, достигающий 10-15-кратной величины для различных опухолей. Препарат Аласенс принимается перорально, 1,5 г разводится на 100 мл питьевой, негазированной воды, за 4 часа до операции. Для возбуждения флюоресценции применяли специальное оборудование KarlStorz системы D-Light C. Спектроскопическое исследование флюоресценции проводили с использованием лазерной электронно-спектральной установки ЛЭСА-01-БИОСПЕК. Для возбуждения флюоресценции применяли гелий-неоновый лазер с длиной волны 630,8 нм и мощностью 25 мВт.
При резекции почки оценивалась зона хирургического края для выполнения наиболее радикального вмешательства, при флюоресцентном контроле регистрировалось наличие или отсутствие зон патологического свечения на резецированной поверхности. Анализ полученных спектров проводили с помощью компьютерной программы LESA-Soft 9.
Оценивали следующие показатели флюоресценции:
- обычное свечение (аутофлюоресценция) нормальной ткани почки без приема фотосенсибилизатора;
- фоновую флюоресценцию здоровых тканей почки с введением фотосенсибилизатора;
- флюоресценция опухоли почки без приема фотосенсибилизатора;
- флюоресценция опухолевой ткани с введением фотосенсебилизатора;
- интенсивность флюоресценции опухоли;
- индекс контрастности флюоресценции в ткани опухоли, равный отношению интенсивности флюоресценции в ткани опухоли к интенсивности флюоресценции непораженной ткани;
- динамика прироста флюоресценции в ткани опухоли.
Выявлено, что препарат «Аласенс» в значительной степени накапливается в опухолевой ткани, относительно нормальной почечной паренхимы и интенсивность флюоресценции значительно выше.
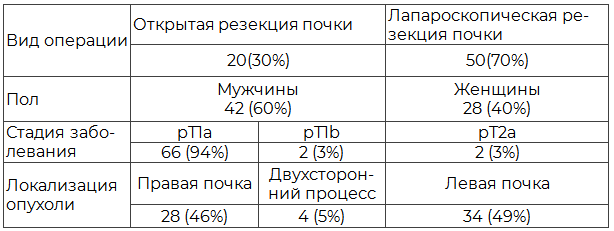
Результаты и их обсуждение. При выполнении резекции почек при ФДД были получены изображения почек в белом и синем цвете. На рис. 1 представлено изображение почки в белом (нативном) свете, на рис. 2 - в синем свете. Отчетливо видно, что при флуоресцентной диагностике отчетливо визуализируется ткань почки с участком ярко-красного свечения, четко видны локализация, размер и границы опухолевой ткани.
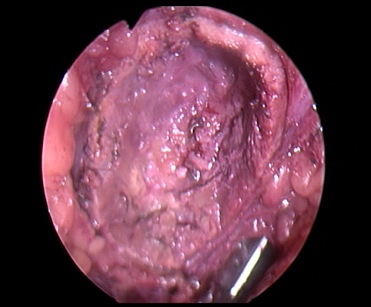
Рис. 1. Хирургический край при резекции почки без флуоресценции.
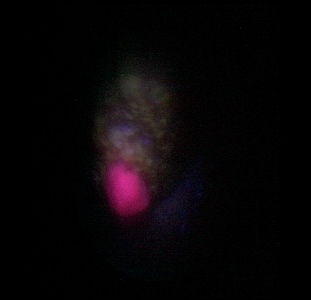
Рис. 2. Хирургический край при резекции почки при флюоресценции.
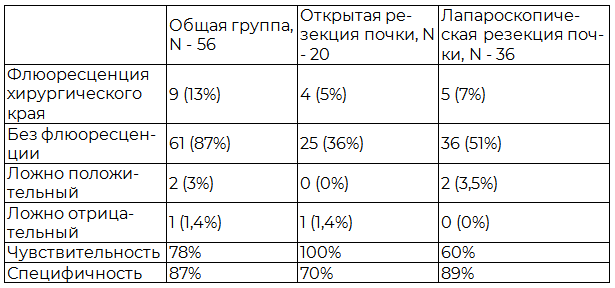
У 61 пациентов (87%) не было обнаружено положительной флюоресценции хирургического края резекции, что было потверждено при гистологическом исследовании. У 9 (13%) пациентов (у 4 пациентов – открытая резекция почки, 5 - лапароскопическая резекция почки) ФД продемонстрировала позитивную флюоресценцию хирургического края. У 7 (10%) пациентов из них результат был подтвержден морфологически, выявлен почечно-клеточный рак, негативная контрольная флюоресценция хирургического края подтвержденная гистологически. У двух пациентов после лапароскопической резекции почки имело место ложноположительная флюоресценция, гистологическое заключение – ангиомиолипома, негативная контрольная флюоресценция хирургического края подтвержденная гистологически.
Чувствительность метода ФД в общей группе составила 78%, специфичность - 87% (табл. 2).
Таблица 2. Результаты ФДД в зависимости от вида операции
После удаления опухолевой ткани была выполнена оценка флюоресценции этой ткани.
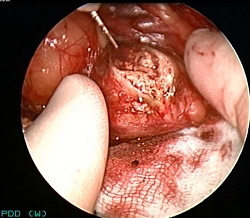
На рис. 3а представлена фотография опухоли после резекции почки в нативном свете, на рис. 3б – фотография с флюоресценцией, четко видна граница между опухолью и нормальной тканью. Опухолевая ткань приобретает светлый цвет (вверху), а нормальная ткань – темный (вокруг).
 |
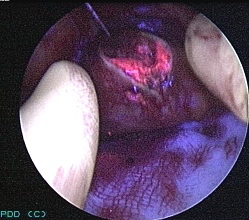 |
| Рис. 3а. Удаленная опухолевая ткань почки без флюоресценции. | Рис. 3б. Удаленная опухолевая ткань почки с флюоресценцией. |
Заключение. Полученные нами предварительные результаты свидетельствуют о том, что препарат аласенс в значительно большей степени накапливается в опухолевой ткани по сравнению с нормальной почечной паренхимой, и интенсивность флюоресценции в опухолевой ткани существенно выше. Исходя из вышеизложенного, можно сделать вывод о высокой эффективности применения метода флюоресцентной диагностики в оценке радикальности оперативного вмешательства при органосохраняющем лечении почечно-клеточного рака, тем самым снижая риск местного рецидива заболевания и, следовательно, повышая продолжительность безрецидивного выживания пациентов. Окончательные выводы будут сделаны по мере накопления большего клинического материала и изучения отдаленных результатов оперативного лечения.
