Введение. В структуре хирургических больных пациенты с наружными грыжами живота составляют до 18%. На долю послеоперационных вентральных грыж (ПОВГ) приходится 20 – 26%. Частота возникновения грыж после лапаротомии варьирует от 2 до 15%. Для ПОВГ характерно быстрое увеличение размеров и склонность к рецидивированию. Обширные и гигантские ПОВГ вызывают у хирургов особую озабоченность и тревогу. Высок уровень местных и общих осложнений, а летальность при плановом вмешательстве достигает 3-7%; при экстренном ‑ 24-35% [1, 2, 4].
Одним из грозных осложнений, возникающим как в раннем, так и в отдаленном послеоперационном периоде является тромбоэмболия ветвей лёгочной артерии. Частота этого осложнения у больных ПОВГ больших размеров приближается к 2,8‑8% [2].
В числе специфических причин венозных тромбоэмболических осложнений у пациентов с грыжами больших размеров следует отметить изменение венозной гемодинамики в результате значительного повышения внутрибрюшного давления, травматичность операции, а также длительно сохраняющееся воспаление в зоне установки синтетического эксплантата [6].
После хирургического вмешательства и имплантации протеза, в этом месте развивается асептическое воспаление, которое принято подразделять на несколько стадий: альтерации, экссудации и пролиферации. С началом стадии регенерации воспалительная реакция уменьшается. В случае длительной экссудации (или других осложнений) воспалительный процесс усиливается. Степень и характер воспалительной реакции на инородное тело зависит также от свойств полимера и от площади контакта с тканями реципиента [3, 5].
Способы пластики грыжевого дефекта у больных ПОВГ отличаются объёмом механической травмы. Пластика onlay требует широкого обнажения апоневроза вокруг грыжевых ворот, в ходе которого на большом протяжении пересекаются лимфатические и кровеносные сосуды. В подкожной клетчатке над протезом создаётся значительная полость. По методике sublay эксплант устанавливается в ретромускулярном или предбрюшинном пространстве, где нет большого количества сосудов, и операция проходит менее травматично. По мнению ряда авторов, после пластики с подапоневротической фиксацией протеза реже развиваются раневые осложнения [1,4, 7].
Цель исследования. Изучить динамику показателей коагуляции после операции грыжесечения с эксплантацией сетчатого протеза у больных ПОВГ больших размеров. Определить влияние воспалительного процесса в послеоперационном периоде на изменение коагуляционного потенциала крови. Улучшить результаты профилактики тромбоэмболических осложнений у больных ПОВГ больших размеров.
Материалы и методы. С 2011 по 2012 г. на базе отделения общей хирургии МСЧ НЯ НПЗ и хирургического отделения № 1 МУЗ «Клиническая больница № 9» проведено исследование, в которое вошли 40 пациентов оперированных по поводу ПОВГ обширных и гигантских размеров. Для отбора больных по размерам грыжевого выпячивания нами использовалась классификация К.Д. Тоскина и В.В. Жебровского. Средний возраст составил 55,6±10,5 лет. Женщин было 22 (55%), мужчин 18 (45%). В ходе предоперационного обследования наиболее часто диагностировались заболевания сердечно-сосудистой системы, ожирение и сахарный диабет. Особое внимание уделяли выявлению патологии венозной системы: варикозной болезнью и посттромбофлебическим синдромом страдали 16 (40%) пациентов. У всех больных имелся высокий риск развития тромбоэмболических осложнений.
Для закрытия грыжевого дефекта мы применяли макропористые монофиламентные сетчатые протезы с высоким содержанием полипропилена: Пролен («Этикон», США) и Эсфил («Линтекс», Россия).
Больные в зависимости от варианта расположения сетчатого протеза были разделены на две группы. В первой группе эксплантат устанавливали на апоневроз по методике «onlay» (n=20); во второй группе протез размещался под апоневроз по методике «sublay» (n=20). В зависимости от степени повышения внутрибрюшного давления в обеих группах применялись «натяжные» и «безнатяжные» методы закрытия грыжевого дефекта.
С целью профилактики раневых осложнений во всех случаях дренировали рану по Редону и отдельно ушивали подкожную клетчатку рассасывающимся шовным материалом. В послеоперационном периоде применяли эластическую компрессию брюшной стенки с помощью абдоминального бандажа. Активное дренирование раны осуществляли в течение всего периода эксудации, при этом удаление дренажей в первой группе происходило на 6,7±2,6 сутки; во второй ‑ на 3,1±0,9 сутки. Для выявления раневых осложнений дополнительно проводили УЗИ области герниотомной раны.
Послеоперационные воспалительные осложнения местного и общего характера развились у 9 (22,5%) больных (табл. 1).
Таблица 1. Послеоперационные осложнения
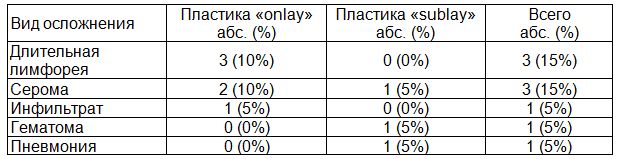
Ретроспективно в зависимости от характера послеоперационного периода все больные повторно были разделены на две группы. В основную группу были выделены пациенты, у которых после операции возникли различные осложнения воспалительного характера (n=9). Учитывались те осложнения, которые потребовали увеличения сроков пребывания пациента в стационаре. В группу сравнения вошли больные с благоприятным течением послеоперационного периода (n=31).
Во всех случаях проводилась профилактика тромбоэмболических осложнений, которая включала назначение низкомолекулярных гепаринов (клексан, фраксипарин – однократно перед операцией и ежедневно после операции на весь срок госпитализации) раннюю активизацию больных, бинтование ног или применение компрессионных чулок.
Для оценки влияния метода пластики грыжевого дефекта и характера послеоперационного периода на коагуляционные свойства крови нами были выбраны следующие лабораторные показатели: фибриноген, С-реактивный белок, Д-димер и антитромбин III. Отбор проб осуществляли перед операцией, на 1-е, 3-е и 10-е сутки после операции. Определение Д‑димера проводили на автоматическом анализаторе IMMULITE 2000 (США) методом твердофазного хемилюминесцентного иммуноферментного анализа. Концентрацию фибриногена по Клаусу и антитромбина III оптическим методом измеряли на коагулометрическом анализаторе SYSMEX CA-1500 (Япония). С-реактивный белок определяли на автоматическом анализаторе DADE BEHRING BN ProSpec (Германия) нефелометрическим методом. В комплекс обследования так же были включены молекулярно-генетические исследования для исключения наследственных тромбофилий: мутации гена фактора V Лейдена (резистентность к активированному протеину С) и мутации гена протромбина G20210A. В конце срока госпитализации для выявления тромбоэмболических осложнений выполняли ультразвуковое дуплексное сканирование вен нижних конечностей.
Статистический анализ полученных данных проводили в демонстрационной версии пакета прикладных программ STATISTICA 6 (StatSoft Inc.). Проверку нормальности распределения количественных признаков выполняли с использованием критерия Шапиро-Уилкса. При сравнении групп по количественному признаку применяли t-критерий Стьюдента и U-критерий Манна-Уитни для независимых выборок. Для сравнения по качественному эффекту применяли точный критерий Фишера. Критическое значение уровня значимости принимали равным 5% (p<0,05).
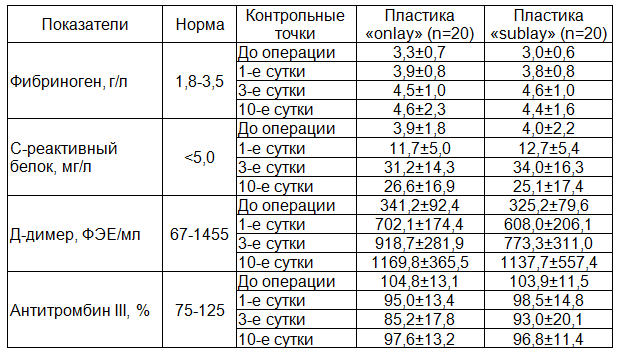
Результаты. При сравнении исходных показателей коагуляционного гемостаза в группах, различающихся по расположению сетчатого протеза, статистически значимых различий не обнаружено. После операции в обеих группах наблюдался рост уровня фибриногена, С-реактивного белка, Д-димера и менее выраженное снижение антитромбина III. Описанные изменения достигали максимума к 3-м суткам (Д-димера к 10-м суткам). Повышение концентрации фибриногена и С-реактивного белка свидетельствует о возникновении очага острого воспаления в ответ на значительную операционную травму. Повышение Д-димера и снижение антитромбина III ‑ индикатор активации параллельно идущих процессов свертывания и фибринолиза. К 10-м суткам зарегистрирована обратная динамика уровня фибриногена, С-реактивного и антитромбина III. Однако разница между изначальными данными и итоговыми результатами по этим показателям оставалась существенной. Концентрация Д-димера продолжала медленно увеличиваться, но при этом в большинстве случаев не выходила за верхнюю границу референтных значений. Описанные изменения в коагулограмме идут параллельно в обеих группах, при этом статистически значимых различий не по одному показателю выявлено не было (табл. 2).
Таблица 2. Показатели коагуляции в группах, различающихся по расположению протеза
После повторного анализа полученных данных были выявлены более существенные изменения в уровне коагуляции у пациентов с осложнённым течением послеоперационного периода. Обнаружены статистически достоверные различия в концентрации фибриногена, С-реактивного белка и Д‑димера на 10-е сутки были по сравнению с аналогичными показателями у больных с благоприятным течением послеоперационного периода. Если в группе сравнения с переходом воспалительного процесса в стадию пролиферации факторы коагуляции снижались, то в основной группе по мере формирования осложнений гиперкоагуляция оставалась на прежнем уровне или нарастала. В генезе тромботических расстройств на данном этапе ведущую роль, предположительно, играет воспалительный процесс в области экспланта. Особенно, это характерно для протезов с высоким содержанием полипропилена, которые при неблагоприятном течении послеоперационного периода являются источником длительно существующего воспаления, что подтверждается высоким уровнем «белков острой фазы» (табл. 3).
Таблица 3. Показатели коагуляции у больных с неосложнённым и осложнённым течением послеоперационного периода
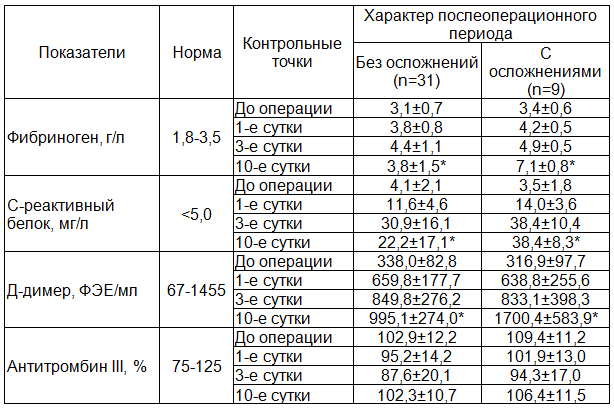
Примечание: * ‑ статистически значимые различия в группах при p<0,05.
При дуплексном сканировании вен ног в конце срока госпитализации выявлено 4 (10%) случая бессимптомных неэмболоопасных тромбозов вен голени: 2 (22,2%) в основной группе и 2 (6,25%) в группе сравнения. Факт тромбоза косвенно подтверждался значениями Д‑димера, выходящими за пределы нормы. Тромбозов, проявивших себя клинически, и случаев тромбоэмболии лёгочной артерии зафиксировано не было.
Выводы:
- Операция грыжесечения с аллопластикой у больных ПОВГ обширных и гигантских размеров сопровождаются гиперкоагуляционными изменениями в системе гемостаза, что опасно развитием тромбоэмболических осложнений.
- Гиперкоагуляция у этой категории больных сохраняется в течение периода, превышающего сроки госпитализации. Общепринятые меры профилактики тромбоэмболических осложнений полностью не компенсируют коагуляционных изменений.
- Выраженность воспаления и изменения в системе свертывания крови у больных ПОВГ больших размеров не зависят от методики эксплантации сетчатого протеза и варианта его расположения относительно апоневроза.
- Местные и общие осложнения воспалительного характера после грыжесечения с протезированием брюшной стенки провоцируют более выраженную гиперкоагуляцию. Адекватная профилактика раневых осложнений снижает вероятность развития тромботических расстройств.
