Лечение ран было и остается основной задачей хирургии, а ведение раны под повязкой по-прежнему является альтернативой инвазивным хирургическим способам решения проблемы. Медицинские повязки сохраняют за собой приоритетное значение, несмотря на появление, весьма эффективных методов связанных с использованием изолированной абактериальной среды, ирригационно-аспирационного или дозированного вакуумного дренирования. Это связано с простотой и доступностью лечения ран под повязками в сложных условиях боевой обстановки и полевых лечебных учреждениях.
В конце XX века T. Turner сформулировал критерии «идеальной» повязки [9]. По его мнению «идеальная» повязка должна отвечать следующим требованиям: удалять экссудат, поддерживать влажную среду, обеспечивать проницаемость для кислорода, поддерживать температуру среды вокруг раны, предотвращать инфицирование раны, не содержать токсичных компонентов, удаляться без повреждения молодой подлежащей ткани.
В дальнейшем эти критерии были дополнены более чем тремя десятками характеристик «идеальной» повязки [3, 5]. И до настоящего времени нигде в мире не создана, так называемая «идеальная» повязка. Однако результаты исследований проводимых многими авторами [1, 4, 8], показали, что новая повязка из эластичного пенополиуретана (ППУ) удовлетворяет многим требованиям, предъявляемым к «идеальной» повязке.
Эластичный, гелеобразный быстрозастывающий ППУ II поколения обеспечивает: хорошие защитные свойства, позволяющие предохранять рану от воздействий внешней среды и вторичного микробного загрязнения, надежную фиксацию к здоровой коже за счет высоких адгезивных свойств этого вспененного полимера; отсутствие прилипания к ране за счет образования полимочевины непосредственно на границе раны и повязки (полимочевина не обладает адгезивными свойствами), что позволяет безболезненно удалять повязку во время перевязки; полную конгруэнтность к рельефу раны; возможность нанесения повязки на любую поверхность тела, в частности на область крупных суставов, не ограничивая объема движения, без дополнительной фиксации бинтами; хорошую абсорбционную емкость; самостерилизацию в момент образования; достижение противоболевого эффекта.
Поэтому мы решили экспериментально изучить влияние ППУ II поколения на процесс заживления ожоговых ран, а также на регенерацию округлых плоскостных и длительно незаживающих ран.
Влияние ППУ повязок II поколения на процесс заживления ожоговых ран
В целях определения эффективности применения ППУ повязки при лечении ожоговых ран были проведены эксперименты на 120 белых беспородных крысах массой 150-200 гр. Все животные были разделены на 4 серии по 30 животных в каждой.
В I серии моделировался ожог IIIА степени; повязки ППУ II поколения не применялись, раны заживали с применением обычных методик.
Во II серии так же моделировался ожог IIIА степени, но раны закрывались повязкой ППУ II поколения до полной эпителизации ран.
В III серии моделировался ожог IIIБ степени, раны заживали с применением обычных методик.
В IV серии моделировался ожог IIIБ степени, раны закрывались повязками ППУ II поколения до полной эпителизации ран.
Результаты применения ППУ повязки оценивались по срокам появления критериев заживления у животных всех четырех групп.
При визуальном наблюдении за ходом заживления ожоговых ран установлено, что на следующий день после нанесения ран у животных всех групп наблюдалось увеличение размеров повреждения, которое зависело от глубины поражения. Последующее уменьшение раневого дефекта начиналось с 3-4-х суток при ожогах IIIА степени, и с 7-10-х суток при поражениях IIIБ степени. Эти сроки соответствовали времени формирования первичного струпа. Раневая поверхность достигала исходных величин (площади контактной пластины) при ожогах IIIА степени, покрытых ППУ повязкой, к 3 - 4 суткам, без нее – к 6-7 , при ожогах IIIБ ст.т – к 10-12 под ППУ повязкой, и к 18-20 – без нее. При ожогах IIIА ст. образовывался струп белесовато-сероватого цвета, формировавшийся к 3-4 суткам под ППУ повязкой, и к 6-7 суткам – без повязки.
При ожогах IIIБ ст. струп темно-коричневого цвета формировался под ППУ повязкой II поколения к 7-8 суткам, а без нее – к 10-11суткам.
Одновременно регистрировались особенности динамики заживления ожоговых ран, находившиеся в прямой зависимости от глубины ожога и применения ППУ повязки. Результаты лечения поверхностных ожоговых ран представлены в табл. 1 и 2, а глубоких – в табл. 3 и 4.
Таблица 1. Сравнительная характеристика заживления ран при ожогах IIIА степени
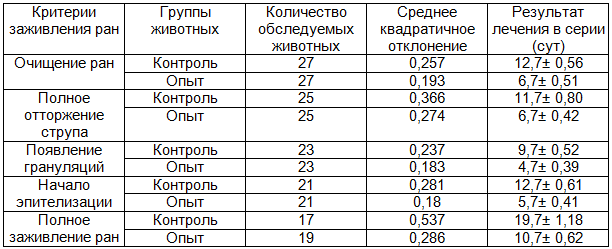
Примечание: здесь и далее статистически значимые различия Р=0,02.
Таблица 2. Динамика заживления ран при ожогах IIIА степени
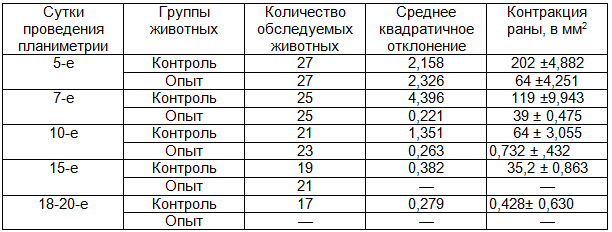
Таблица 3. Сравнительная характеристика заживления ран при ожогах ШБ степени
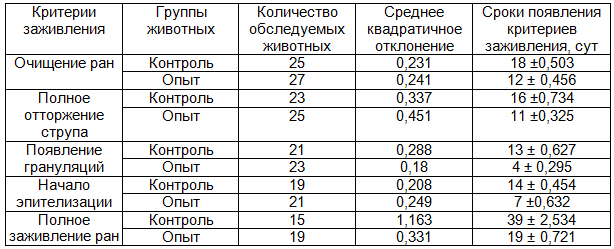
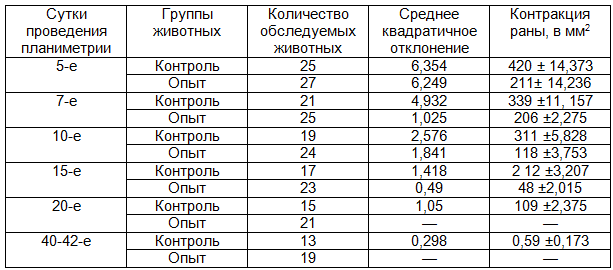
Таблица 4. Динамика заживления ран при ожогах IIIБ степени
После применения ППУ повязок происходило заметное сокращение сроков появления некоторых критериев заживления ожоговых ран - отторжения струпа, очищения раны от гнойно-некротических тканей, появления грануляций, начала эпителизации и полного заживления ран.
По данным исследований [7], самостоятельное заживление постожоговой гранулирующей раны диаметром более 5 см путем краевой эпителизации у человека обычно невозможно. Спонтанное заживление ожоговых ран IIIБ ст. при моделировании травм на крысах было обусловлено присущими им особенностями заживления ран, сравнительно малыми размерами ожогов (13 мм в диаметре), а также созданием оптимальных условий заживления под ППУ повязкой.
Так, полное очищение ран при ожогах IIIА степени наступало через 6±0,5 суток от времени нанесения травмы у животных, при использовании ППУ повязки, и через 12±0,6 суток у животных контрольной серии. При ожогах IIIБ степени эти показатели соответственно составляли 12±0,5 и 18±0,5 суток.
Сроки полного заживления раневого дефекта при ожогах IIIА степени под ППУ повязкой составляли 10±0,6 суток, а без нее – 19±1,2 суток. При ожогах IIIБ степени эти показатели составляли соответственно 19±0,7 и 39±2,5 суток.
Результаты экспериментов обработаны на IBM Pentium 4 c использованием пакета программ «СТАТИСТИКА 6.0» методом дисперсионного анализа по двухфакторной модели [2], а для попарного сравнения выбран критерий Ньюмена-Кейлса, при нормальном распределении значения данных. Статистически значимые различия Р=0,02.
Положительное влияние ППУ повязки II поколения на процесс заживления ожоговых ран подтверждено и данными гистологических исследований срезов тканей, подвергшихся термическому воздействию. Всего исследовано 36 срезов, подвергшихся термическому воздействию.
В 18 исследованиях у животных контрольной группы при ожогах IIIА степени отмечался некроз эпидермального покрова, гомогенизация подлежащих отделов дермы с явлениями кариопикноза ее клеточных элементов, коагуляционный некроз корней волос с сохранением в большей части их очертаний, значительная оксифилия некротизированной части дермы. В дерме наблюдалось резкое набухание коллагеновых волокон с плохо различимыми границами между ними. Жировая клетчатка была интактной, ядра миоцитов и межклеточные границы сохранялись.
При ожогах IIIБ степени обнаруживалось повреждение всей толщи эпителиального покрова. Наблюдался коагуляционный некроз эпителия. Аналогичные процессы происходили и с волосяным покровом, причем очертания корней волос и волосяные луковицы нередко сохраняли свои очертания, но клеточные структуры их становились совершенно неразличимыми. Коагуляционный некроз захватывал и собственно дерму, где обнаруживались некротизированные клеточные элементы с явлениями резко выраженного кариопикноза. В большинстве срезов явления некроза дермы наблюдались вплоть до жировой клетчатки, а в ряде случаев отмечалось поражение и самой подкожно-жировой клетчатки.
Гистологическое исследование тканей ожоговых ран, лечившихся под ППУ повязкой показало, что имела место картина сходная с ранее описанной. Отмечалось ускорение пролиферации клеточных элементов дермы, в основном за счет фибробластов. В целом же, отмечалось более раннее созревание соединительной ткани главным образом коллагеновых волокон.
Анализ основных статистических показателей заживления ожоговых ран и данных гистологического исследования позволяет сделать ряд выводов:
- Во-первых, закрытие ожоговых ран ППУ повязкой, независимо от степени ожога, способствует более раннему очищению раневой поверхности от гнойно-некротических тканей.
- Во-вторых, в результате применения ППУ повязки происходит значительное сокращение сроков формирования и отторжения ожогового струпа, появления грануляционной ткани.
- В-третьих, при использовании ППУ повязок в лечении поверхностных и ограниченных по площади глубоких ожогов значительно сокращаются и сроки полной эпителизации раневой поверхности.
Влияние ППУ повязок II поколения на регенерацию округлых плоскостных и длительно незаживающих ран
В целях определения эффективности применения ППУ повязок II поколения для лечения плоскостных округлых и длительно незаживающих ран были проведены эксперименты на 120 белых беспородных крысах массой 150-200 гр. Все животные были разделены на 4 серии по 30 животных в каждой.
I группа - здоровые животные, которым наносились округлые плоскостные раны со средней площадью 165±15 мм2. Лечение проводилось обычными методами.
II группа - здоровые животные с аналогичными ранами, у которых применялась ППУ повязка II поколения до полного заживления повреждений.
III группа - животные с длительно незаживающими ранами, которые моделировались путем нанесениям округлой плоскостной раны на фоне искусственно вызываемого аллоксанового диабета. Лечение проводилось обычными методами.
IV группа - животные с длительно незаживающими ранами, которые моделировались путем нанесениям плоскостной округлой раны на фоне искусственно вызываемого аллоксанового диабета. Лечение проводилось под ППУ повязкой II поколения.
При визуальном наблюдении за процессом заживления плоскостной округлой раны у здоровых животных выявлены следующие изменения. Сразу после нанесения рана несколько минут слабо кровоточила. В течение первых суток происходило увеличение ее площади приблизительно на 10% по отношению к исходной при минимальном кровотечении. На вторые сутки рана интенсивно сокращалась и становилась меньше исходной, в среднем, на 20% . Поверхность ее покрывалась нежной коричневой корочкой, кровотечение прекращалось. На третьи сутки обычно образовывался первичный коричневый струп толщиной до 3 мм, под которым происходила эпителизация раны в течение 7-10 суток. Позже первичный некротический струп либо отпадал с образованием в последующем вторичного струпа, либо сохранялся до полного заживления под ним кожного дефекта. Полная эпителизация округлой плоскостной раны у здоровых животных происходила неравномерно. Так, скорость эпителизации нарастала к концу первой недели, когда заживало, в среднем, 60% раневой поверхности. Затем этот процесс несколько замедлялся, что по-видимому, было связано с формированием плотного первичного струпа. За вторую неделю эпителизировалось еще 33% площади раны и лишь в последующие пять суток процесс заживления раны завершался. Аллоксановый диабет отягощал течение репаративных процессов замедлял очищение ран, рост грануляций и дальнейшую эпителизацию раневой поверхности у крыс. На второй день после нанесения раны больному животному, контракция ее была выражена незначительно и за первую неделю площадь раны уменьшалась лишь на 7-9% от исходной.
Рана покрывалась фибринозным налетом, количество отделяемого увеличивалось. С 7-8 суток начиналось очищение ран от налетов и некротических тканей, процесс заживления ускорялся, образовывался струп, под которым и происходила дальнейшая эпителизация. Струп, как правило, был рыхлым, легко удалялся с образованием вяло-гранулирующего дефекта. Сравнительная характеристика результатов проводимого лечения с применением ППУ повязки II поколения показана в табл. 5 и 6.
Таблица 5. Сравнительная характеристика заживления округлых плоскостных ран
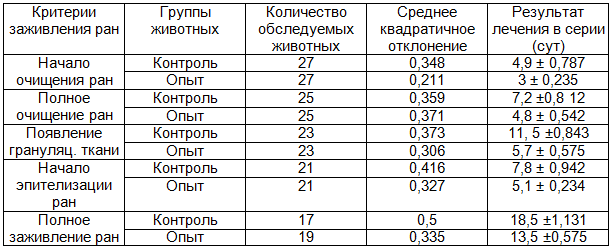
Статистически значимые различия Р=0,02.
Таблица 6. Сравнительная характеристика заживления длительно незаживающих ран
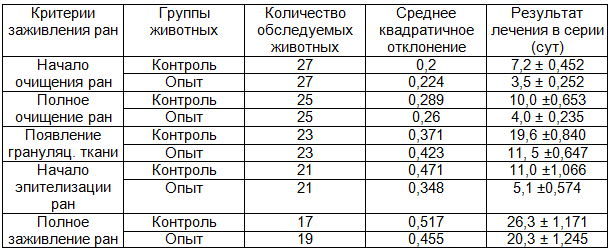
Наблюдения за самопроизвольным заживлением ран у здоровых животных и у крыс, больных аллоксановым диабетом, позволило сделать заключение о том, что избранная модель позволяет изучать влияние пенополиуретановых повязок на заживление длительно незаживающих ран и в определенной мере, по нашему предположению и трофических язв.
Как и в предыдущих наблюдениях процесса заживления ожоговых ран, оценка влияния ППУ повязок II поколения на регенерацию длительно незаживающих ран проводилась по нескольким показателям. В эксперименте нами было установлено, что закрытие ППУ повязкой округлой плоскостной раны вызывало активную контракцию ее в первые 3-5 суток, когда исходная площадь раны уменьшалась на 23,47±0,2% при средней скорости заживления 12,2±2,1 мм2 в сутки. Динамика заживления округлых плоскостных ран и длительно незаживающих в табл.7 и 8.
Таблица 7. Динамика заживления округлых плоскостных ран
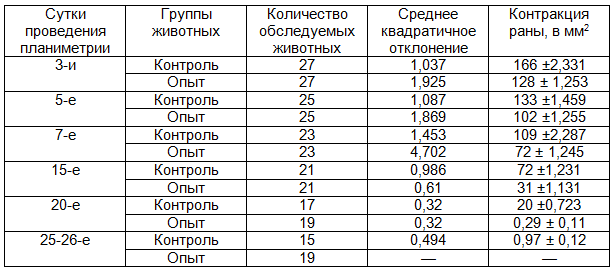
Таблица 8. Динамика заживления длительно не заживающих ран
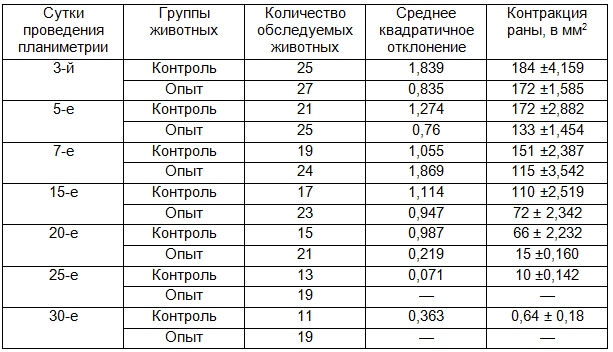
Оценка результатов экспериментов в случаях с округлыми плоскостными и длительно незаживающими ранами осуществлялась по внешнему виду ран, по очищению их от некротических тканей, появлению и отторжению струпа, активизации роста грануляционной ткани, началу эпителизации, полному заживлению раневой поверхности, а также по поведенческим реакциям животных во время перевязок и между ними. Одновременно проводилось измерение степени контракции раневого дефекта в динамике. Измерение площади раневого дефекта в процессе репаративной регенерации ожоговых и длительно незаживающих ран проводилось на 3,5,7,15,20,25 и 30 сутки, с определением величины относительного уменьшения размеров раны по формуле В.С.Песчанского [6].
При проведении бактериологических исследований было установлено следующее. Бактериостатический и бактерицидный эффект пенополиуретанового покрытия исследовался сразу же после завершения реакции полимеризации на жидких и плотных питательных средах с помощью классических бактериологических и бактериостатических методов в опытах in vitro. В качестве тест-микробов использованы стандартные штаммы гноеродной флоры-стафилококки (штамм 600) и палочка сине-зеленого гноя (штамм Тесаков), полученные из коллекции Государственного научно-исследовательского института стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича и выделенные от больных, лечившихся в Российском ожоговом центре ННИИТО г. Нижний Новгород.
Результаты исследования показали отсутствие непосредственного и отдаленного по времени бактерицидного и бактериостатического эффекта при непосредственном контакте полимеризированного состава ППУ с микробной флорой в лабораторной посуде (in vitro). Но при нанесении ППУ II поколения в виде геля, на жидкие и плотные питательные среды с использованием тех же тест-микробов, о которых написано выше, мы отметили эффект сдерживания колонизации микробной флоры в 1,5 - 2,0 раза, что связано с бактерицидным действием остаточных эпоксигрупп образовавшихся в геле при взаимодействии полиолов с изоцианатами в момент реакции полимеризации, которые в конечном итоге самостерилизуют пенополиуретановую композицию.
Таким образом, обобщая изложенное выше, можно заключить, что имеются все основания для применения повязки ППУ II поколения в комплексном лечении больных с различными ранами мягких тканей в условиях хирургических и ожоговых стационаров.
